目次
がん免疫療法とは
がん免疫療法とは、がん細胞を攻撃するために免疫システムを活用する治療法のことです。免疫療法の特徴的な作用機序のため、腫瘍に対する反応や薬物有害反応など、従来の抗悪性腫瘍薬と異なる事象(免疫関連事象)が発生します。がん免疫療法には、モノクローナル抗体やがんワクチン、エフェクター細胞治療など様々な種類がありますが、ここ10年以上注目されているのは、ニボルマブやペムブロリズマブに代表される免疫チェックポイント阻害剤と呼ばれる薬剤です。免疫チェックポイント阻害剤は、がん細胞が免疫系を抑制するために発現する分子(CTLA-4、PD-1、PD-L1など)を阻害することで、免疫細胞の活性化を促進します。現在、悪性黒色腫、非小細胞肺がん、腎細胞がん、ホジキンリンパ腫、頭頸部癌、食道がん、MSI-High固形がんなど、多くのがん種が適応疾患として承認されています1)。
がん免疫療法の腫瘍縮小パターン
がん免疫療法は、画像検査において従来の抗悪性腫瘍薬の腫瘍縮小パターンとは異なる変化が認められることがあります。偽増悪(Pseudo progression)は、がん免疫療法の腫瘍縮小パターンの特徴のひとつです。偽増悪とは、がん免疫療法による治療開始後に腫瘍の増大や新しい病変の出現が確認された後、腫瘍が縮小する腫瘍縮小パターンであり、本来は治療効果があるのにかかわらず、画像上、一過性で腫瘍が増大または出現するのが特徴です。偽増悪のメカニズムとしては、がん免疫療法の間接的な作用機序による遅発的な腫瘍縮小の影響、リンパ球の腫瘍への遊走および浸潤が考えられています。しかしながら、偽増悪の腫瘍縮小パターンは必ずしもすべての患者に見られるわけではなく、個人差やがん種によっても異なりますが、10%以下であることが報告されています2)。
がん免疫療法の治療効果判定基準の特徴
従来の抗悪性腫瘍薬では、治療効果判定基準としてRECIST 1.1(Response Evaluation Criteria in Solid Tumors)3)が広く用いられています。RECIST 1.1の概要は「固形がんの治療効果 RECIST 1.1 評価の方法(https://micron-kobe.com/archives/works/blog20230809)」を参照してください。RECIST 1.1では、腫瘍の増大や新病変の出現が認めらえると、病勢進行(PD; progressive disease)と定義され、無増悪生存期間(PFS; progression-free survival)の算出におけるイベントとされます。がん免疫療法を治療する患者をRECIST 1.1で評価する際、一部の患者で一過性の腫瘍サイズ増大や新しい病変の出現によりPDと判定されることがあり、その結果、患者の腫瘍縮小効果の評価が適切に行われないことがあります。
がん免疫療法に特徴的な腫瘍縮小パターンを反映する新しい効果判定基準の導入が求められてきました。その結果、2009年にirRC4)、2013年にirRECIST5)、2017年にiRECIST6) などが提案されました。これらのがん免疫療法特有の基準は、一度の画像検査での腫瘍量増大をもってすぐにPDと判定せず、続く評価時点での腫瘍量変化を再確認する手法を採用しています(以下図参照)。
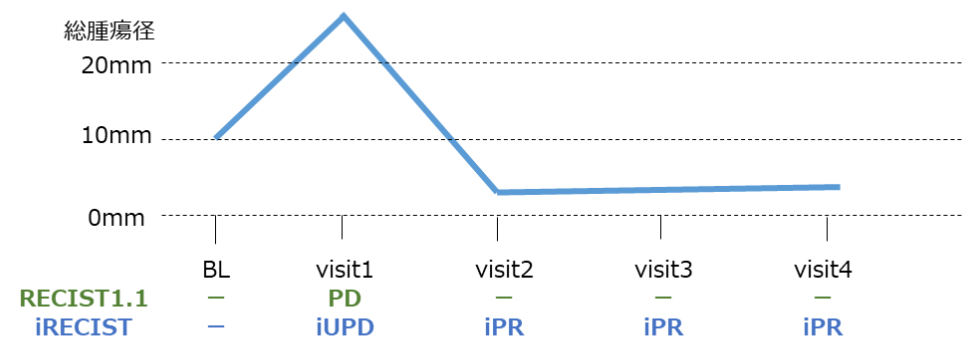
以下に3つのがん免疫療法の治療効果判定基準(irRC、irRECIST、iRECIST)とRECIST 1.1の比較を示します。なお、iRECISTの詳細は「iRECISTの概要(https://micron-kobe.com/archives/post/mvp5_irecist)」を参照してください。
| irRC | irRECIST | iRECIST | RECIST 1.1 | |
| 病変の測定 | 二方向測定 | 一方向測定 | 一方向測定 | 一方向測定 |
|
BLの標的病変サイズ |
5mm × 5mm以上 |
非リンパ節:長径10mm以上 リンパ節:短径15mm以上 |
非リンパ節:長径10mm以上 リンパ節:短径15mm以上 |
非リンパ節:長径10mm以上 リンパ節:短径15mm以上 |
|
BLの標的病変数 |
合計10個 各臓器5個まで |
合計5個 各臓器2個まで |
合計5個 各臓器2個まで |
合計5個 各臓器2個まで |
|
新病変の測定 |
総腫瘍径に含める |
総腫瘍径に含める |
総腫瘍径に含めない |
計測不要 |
| 効果 |
CR:すべての病変の消失 PR:BLの総腫瘍径より50%以上の縮小 SD:PRでもなくPDでもない PD:総腫瘍径の最小値より25%以上の増大 |
CR:すべての病変の消失 PR:BLの総腫瘍径より30%以上の縮小 SD:PRでもなくPDでもない PD:最小値の総腫瘍径から20%以上の増大(かつ5mm以上の増大) |
CR:すべての病変の消失 PR:BLの総腫瘍径より30%以上の縮小 SD:PRでもなくPDでもない PD:最小値の総腫瘍径から20%以上の増大(かつ5mm以上の増大) |
CR:すべての病変の消失 PR:BLの総腫瘍径より30%以上の縮小 SD:PRでもなくPDでもない PD:最小値の総腫瘍径から20%以上の増大(かつ5mm以上の増大) |
|
PDの確定 |
PD確定に 4週必要 |
PD確定に 4週必要 |
4-8週 |
不要 |
その他のがん免疫療法の治療効果判定基準
がん免疫療法の治療効果判定基準は、以下表のような疾患や画像検査にも依存した治療効果判定基準が提案されています。どの基準にも共通して、一度の腫瘍量の増大や新病変の出現でPDとせず、引き続き画像検査を実施してPDであることを確定する手順を採用しています。
|
治療効果判定基準 |
説明 |
|
LYRIC7) |
悪性リンパ腫の治療効果判定基準であるLugano基準をもとに提案された、がん免疫療法における悪性リンパ腫の治療効果判定基準 |
|
iPERCIST8) |
18F-FDG-PET検査を利用した治療効果判定基準であるPERCISTをもとに提案された、がん免疫療法のグルコース代謝機能評価の治療効果判定基準 |
|
iRANO9) |
悪性神経膠腫の治療効果判定基準であるRANO基準をもとに提案された、がん免疫療法における悪性神経膠腫の治療効果判定基準 |
|
itRECIST10) |
腫瘍病変に直接的に免疫増強薬を投与するヒト腫瘍内免疫療法(HIT-IT; human intratumoral therapy)に対する治療効果判定基準 |
終わりに
がん免疫療法は、一部の患者において従来の抗悪性腫瘍薬とは異なる腫瘍縮小パターンがあり、RECIST 1.1では腫瘍縮小効果を適切に評価できない場合があります。irRC、irRECIST、iRECISTのようながん免疫療法の治療効果判定基準を用いることで、患者の腫瘍縮小効果を適切に評価することができます。PMDAが発表した「抗悪性腫瘍薬の臨床評価方法に関するガイドライン」11)では、がん免疫療法の臨床試験において、RECIST 1.1による評価に加え、がん免疫療法の治療効果判定基準を用いた評価について言及しており、がん免疫療法の治療効果判定基準の利用が進むと考えられます。
参考文献
-
日本臨床腫瘍学会, がん免疫療法ガイドライン 第3版
-
Nishino M, Hatabu H, Hodi FS (2019) Imaging of cancer immunotherapy: current approaches and future directions. Radiology 290:9–22
-
Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M, Rubinstein L, Shankar L, Dodd L, Kaplan R, Lacombe D, Verweij J. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009 Jan;45(2):228-47.
-
Wolchok JD, Hoos A, O’Day S, Weber JS, Hamid O, Lebbé C, Maio M, Binder M, Bohnsack O, Nichol G, Humphrey R, Hodi FS. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin Cancer Res. 2009 Dec 1;15(23):7412-20.
-
Nishino M, Giobbie-Hurder A, Gargano M, Suda M, Ramaiya NH, Hodi FS. Developing a common language for tumor response to immunotherapy: immune-related response criteria using unidimensional measurements. Clin Cancer Res. 2013 Jul 15;19(14):3936-43.
-
Seymour L, Bogaerts J, Perrone A, Ford R, Schwartz LH, Mandrekar S, Lin NU, Litière S, Dancey J, Chen A, Hodi FS, Therasse P, Hoekstra OS, Shankar LK, Wolchok JD, Ballinger M, Caramella C, de Vries EGE; RECIST working group. iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics. Lancet Oncol. 2017 Mar;18(3):e143-e152. doi: 10.1016/S1470-2045(17)30074-8. Epub 2017 Mar 2. Erratum in: Lancet Oncol. 2019 May;20(5):e242.
-
Cheson BD, Ansell S, Schwartz L, Gordon LI, Advani R, Jacene HA, Hoos A, Barrington SF, Armand P. Refinement of the Lugano Classification lymphoma response criteria in the era of immunomodulatory therapy. Blood. 2016 Nov 24;128(21):2489-2496. doi: 10.1182/blood-2016-05-718528. Epub 2016 Aug 29.
-
Goldfarb L, Duchemann B, Chouahnia K, Zelek L, Soussan M. Monitoring anti-PD-1-based immunotherapy in non-small cell lung cancer with FDG PET: introduction of iPERCIST. EJNMMI Res. 2019 Jan 29;9(1):8.
-
Okada H, Weller M, Huang R, Finocchiaro G, Gilbert MR, Wick W, Ellingson BM, Hashimoto N, Pollack IF, Brandes AA, Franceschi E, Herold-Mende C, Nayak L, Panigrahy A, Pope WB, Prins R, Sampson JH, Wen PY, Reardon DA. Immunotherapy response assessment in neuro-oncology: a report of the RANO working group. Lancet Oncol. 2015 Nov;16(15):e534-e542.
-
Goldmacher GV, Khilnani AD, Andtbacka RHI, Luke JJ, Hodi FS, Marabelle A, Harrington K, Perrone A, Tse A, Madoff DC, Schwartz LH. Response Criteria for Intratumoral Immunotherapy in Solid Tumors: itRECIST. J Clin Oncol. 2020 Aug 10;38(23):2667-2676.
-
令和3年3月 3 1 日 薬生薬審発 0331 第1号, 抗悪性腫瘍薬の臨床評価方法に関するガイドライン
